Gesundheitspolitische Rahmenbedingungen
Das Gesundheitssystem setzt heute zu wenig Anreize dafür, die wirksamsten Therapien zu entwickeln und zum Einsatz zu bringen. Anpassungen sind notwendig, um sowohl die Versorgung zu verbessern als auch Ineffizienzen zu beseitigen und eine höhere Wertschöpfung am Standort zu ermöglichen. Die Regulatorik muss auf das notwendige Maß reduziert werden, um die Wettbewerbsfähigkeit nicht zu beeinträchtigen.
Gerade die Pharmabranche befindet sich in einem Spannungsfeld der deutschen Gesundheitspolitik: Einerseits steht das Gesundheitssystem insgesamt vor der Herausforderung, die Kosten im Griff zu behalten. Andererseits sollen innovative Therapien entwickelt und die zuverlässige Versorgung mit Medikamenten am Standort gesichert werden. Gesundheitspolitische Dämpfungsmaßnahmen, etwa Preismoratorien oder Zwangsabschläge, dienen dem ersten Ziel (mit ungewissem Erfolg), schwächen aber zugleich die Wettbewerbsfähigkeit der Branche und behindern die Entwicklung innovativer Medikamente; teilweise gestaltet sich sogar die Versorgung mit bestimmten Medikamenten am Standort kritisch.
Der Zukunftsrat empfiehlt

Zulassungsverfahren und Preisfestsetzung
Die Zulassungsverfahren für neue Produkte und Dienstleistungen, neue Untersuchungs- und Behandlungsverfahren sind sehr komplex und langwierig. In manchen Bereichen stellen sich zudem Abgrenzungsschwierigkeiten, wie etwa bei der Frage, ob Innovationen aus dem Bereich der Immunonkologie noch Arzneimittel oder medizinische Verfahren sind. Von der Antwort hängen wiederum unterschiedliche Zulassungswege ab. Im Vergleich zu anderen Ländern findet zudem ein weniger intensiver Dialog mit der Zulassungsstelle statt.
Dass ein Zusatznutzen von innovativen Präparaten im Vergleich zur Standardtherapie nachgewiesen werden muss, ist richtig. Es muss dabei allerdings sichergestellt werden, dass nur Vergleichsprodukte als Referenz herangezogen werden, die tatsächlich denselben Anwendungsfall (z. B. Einsatz in der Schwangerschaft, bei bestimmten Vorerkrankungen etc.) adressieren, und nicht einfach irgendein Generikum, das ebenfalls zur Behandlung der fraglichen Krankheit eingesetzt wird. Gegenwärtig geschieht dies bei der Nutzenbewertung neuer Produkte allzu oft, mit dem Ziel, einen niedrigen Preis durchsetzen zu können. 70 Prozent beziehen sich auf die Vergleichstherapie mit Generika, die in der Regel bei etwa 20 Euro liegen und somit keinen Erfinderlohn mehr berücksichtigen können. Bei einem Zusatznutzen ist das allerdings nicht zu rechtfertigen. Im Ergebnis kann das dazu führen, dass wegen der unüberbrückbaren Preisdifferenz zum Generikum keine Einigung zustande kommt. Die Konsequenz ist, dass neu entwickelte Produkte entweder gar nicht auf den Markt gebracht oder wieder vom Markt genommen werden. Im Ergebnis entstehen bei uns Lieferengpässe für das speziellere Präparat, und die Krankenkassen greifen im Einzelfall zum Import aus Nachbarstaaten. Ein Lösungsansatz wäre, nach Patientengruppen differenzierte Preise zu vereinbaren, um den Zusatznutzen für diese Gruppen auch preislich abzubilden.
Problematisch ist auch, dass die deutsche Methode der Nutzenbewertung weltweit einzigartig ist. 80 Prozent der Anträge scheitern aus formalen Gründen, etwa wegen der Patientenauswahl bei den Tests. Die Folgen bleiben nicht auf den Standort Deutschland beschränkt: Viele Länder machen ihre nationale Zulassung wiederum von einem Vertrieb im Produktionsland abhängig.
Wir müssen neue Wege für eine schnellere, transparentere und international gängige Abwicklung der Zulassungsverfahren finden.
Nutzenbewertung und Preisverhandlung müssen dabei voneinander getrennt werden: Heute ist bei den Erstattungspreisen für Innovationen mit nachgewiesenem Zusatznutzen der GKV-Spitzenverband Spieler, Schiedsrichter und Regelgeber in einem. Die Preisfestsetzung findet notfalls durch eine Schiedsstelle statt, ein „free pricing“ ist im Bereich der verschreibungspflichtigen Medikamente nicht vorgesehen. Eine Klagemöglichkeit des Herstellers gibt es erst gegen den Schiedsspruch. Eine denkbare Lösung ist es, zwei verschiedenen Stellen die Zuständigkeit zu übertragen, einfacher umsetzbar dürfte es aber sein, nach erfolgreicher Nutzenbewertung auch eine freie Preisfestlegung als Option vorzusehen.
Erstattungsbedingungen
Erstattungssystem vereinfachen + Bürokratie abbauen
Das Erstattungssystem ist extrem komplex und von einer Vielzahl von gesundheitspolitischen Spargesetzen geprägt. Heute gibt es mehr als 30 verschiedene Markt- bzw. Preisregulierungsinstrumente im medizinischen Sektor, die teilweise kumulativ angewandt werden. Ziel muss sein, jeweils nur ein Preisregulierungsinstrument pro Marktsegment zu haben.
Ein Beispiel ist der „Zwangsrabatt“ (Herstellerabschlag für Arzneimittel im Sinne eines Mengenrabatts), der heute z. B. für erstattungsfähige Arzneimittel ohne Festbetrag gesetzlich auf sieben Prozent festgelegt ist und je nach Finanzlage der GKV in Abhängigkeit von externen Ereignissen (Dotcom-Blase, Bankenkrise etc.) schwankt. Neben Arzneimittelmarktneuordnungsgesetz (AMNOG) und Festpreisen, Ausschreibungen und Selektivverträgen ist kein Platz mehr für einen zusätzlichen Rabatt.
Ein weiteres Beispiel sind die Apotheken: Das SGB V gibt ihnen eine (Re-) Importquote von mindestens fünf Prozent vor. Sie führt zu erheblicher zusätzlicher Bürokratie und sollte abgeschafft werden.
Ausschreibungen
Ausschreibungsverfahren machen erst ab einer gewissen kritischen Menge an Anbietern Sinn. Es wird daher zu Recht diskutiert, die Regularien zu ändern. Denkbare Ansätze sind der Einsatz von Ausschreibungsverfahren erst ab mindestens vier Anbietern oder die Erteilung des Zuschlags an mindestens drei Anbieter.
Festbetragsmarkt
Die Erstattungshöchstbeträge für Gruppen vergleichbarer Fertigarzneimittel (Festbetragsmarkt) führen zu Kellertreppeneffekten. Nicht alle Hersteller können die Preise entsprechend anpassen. Aufzahlungsprodukte treffen vor allem diejenigen Gruppen, für die keine gleichwertigen Arzneimittel ohne Aufzahlung verfügbar sind (Kinder, Ältere, besondere Darreichungsformen, z. B. für Menschen mit Schluckbeschwerden). Auch hier ist eine differenzierte Betrachtung erforderlich.
Preisbildung bei Medikamenten für seltene Erkrankungen
Die sogenannten „Mondpreise“ für Medikamente sind oft in Wahrheit keine. Mehr als 40 Prozent der Preisunterschiede sind auf die Größe der Patientenpopulation zurückzuführen. Weitere Elemente der Preisbildung sind die Fixkosten sowie die Innovationshöhe. All das muss der Preis abbilden, um Innovationen zu fördern. Das sogenannte Risk Sharing (Erstattung nur bei Nutzen) ist auch in Deutschland möglich und in diesem Bereich grundsätzlich sinnvoll, problematisch ist dabei allerdings die Compliance (Therapietreue) des Patienten. Hier können perspektivisch neue technologische Ansätze (etwa Medizin, die registriert, ob sie termingerecht eingenommen wurde, oder „Depotlösungen“, d. h. Präparate, die die Dosis nach und nach abgeben) die Lösung darstellen. Das muss wiederum bei der Forschungsförderung berücksichtigt werden.
Stärkere Ausrichtung auf neue Produkte und Verfahren
Wir brauchen eine deutliche Verkürzung des Verfahrens gerade auch für die Aufnahme digitaler Gesundheitsanwendungen in die Regelversorgung. Bisher gibt es in den Bereichen digitale „Arznei“ und Telemedizin noch keine sogenannte EBM-Ziffer (einheitlicher Bewertungsmaßstab), die für die Abrechnung durch den Arzt mit der Kassenärztlichen Vereinigung erforderlich wäre.
Die Erprobung, Nutzenbewertung und Kostenbetrachtung von innovativen medizintechnischen Verfahren und Produkten müssen auch der Entwicklung hin zu einer zunehmend individualisieren Medizin Rechnung tragen und dafür neue Methoden (u. a. Entwicklung geeigneter Bewertungskriterien, Anpassung klinischer Prüfungen und Studien) entwickeln. Nur so ist eine Kostenübernahme von Biomarker-Diagnostik/personalisierter Therapie durch die Krankenkassen möglich. Die klassischen Methoden stellen auf statistische Werte ab und stoßen an ihre Grenzen, wenn die Zielwerte auf der individuellen Ebene definiert werden müssen. Die Herausforderung besteht also darin, auf Basis gesicherten wissenschaftlichen Handelns Nutzen- und Risikobewertungen zu implementieren, die sich auf das individuelle Behandlungsziel beziehen. Für allgemeine Aussagen zum Nutzen bestimmter Verfahren sind längere Beobachtungszeiträume und entsprechend auch längere Förderperioden erforderlich. Um die Zulassung nicht hinauszuzögern, müssen dafür schneller zu überprüfende Parameter definiert werden. Dies muss unter Beteiligung von Wissenschaft und forschender Industrie erfolgen.
Bewertung der bisherigen Verfahren
Parallel zur Entwicklung neuer Methoden und als Grundlage für die Neuausrichtung von Zulassungsverfahren, Preisfestsetzung und Erstattungsbedingungen müssen die Auswirkungen der bisherigen Verfahren – gerade auch im internationalen Vergleich – im Hinblick auf Versorgungsqualität, Kosten und Wettbewerbsfähigkeit bzw. Leistungsfähigkeit unserer Unternehmens- und Forschungslandschaft evaluiert werden.
Dabei muss auch untersucht werden, ob von den Preissetzungsmechanismen die richtige – gesamtgesellschaftlich erwünschte – Lenkungswirkung ausgeht, also z. B. Forschungsanreize für Therapiegebiete mit hohem medizinischen Bedarf gesetzt werden. Dabei ist eine ganzheitliche Sicht (nicht begrenzt auf Klinik, Zahnmedizin, Pflege usw.) erforderlich, die beispielsweise Nachsorge und Folgebehandlungen berücksichtigt. Auf Grundlage dieser Ergebnisse muss regelmäßig im Erstattungsverfahren nachgesteuert werden.
Health Technology Assessment
Es fehlt an einem umfassenden Health Technology Assessment (HTA, zu Deutsch etwa Medizin-Technikfolgenabschätzung). Andere Länder errechnen, was beispielsweise ein neues Medikament für das Gesundheitssystem insgesamt an Einsparungen bringen kann: ambulante statt stationäre Behandlung, Erhalt der Erwerbsfähigkeit etc. Ein solches System muss – nicht nur für Medikamente und Medizintechnik im engeren Sinne, sondern z. B. auch für Anwendungen aus dem Bereich E-Health – wesentlich breiter genutzt werden. Aktuell werden nur einzelne ausgewählte Themen behandelt, für die es schon ausreichend Publikationen gibt, und es werden insbesondere in aller Regel keine Innovationen bewertet, sondern nur Technologien, die sich bereits im Einsatz befinden.
Es darf aber nicht nur darum gehen, den Nutzen bestehender Technologien zu hinterfragen und ggf. den Leistungskatalog der Krankenkassen zu kürzen, sondern auch darum die Wirkungen neuer – unter Umständen auch aufwändiger und teurer – Technologien umfassend abzuschätzen, ganz im Sinne einer Medizin-Technikchancenabschätzung.
In einem nächsten Schritt ist eine Harmonisierung der Nutzenbewertung einschließlich HTA auf europäischer Ebene sinnvoll: Gegenwärtig gibt es trotz eines seit Anfang der 90er-Jahre existierenden internationalen und eines europäischen Netzwerks (International bzw. European Network of Agencies for Health Technology Assessment) in den einzelnen europäischen Ländern verschiedene Goldstandards und keine gegenseitige Anerkennung bei der Nutzenbewertung; nur die Zulassung ist europäisch.
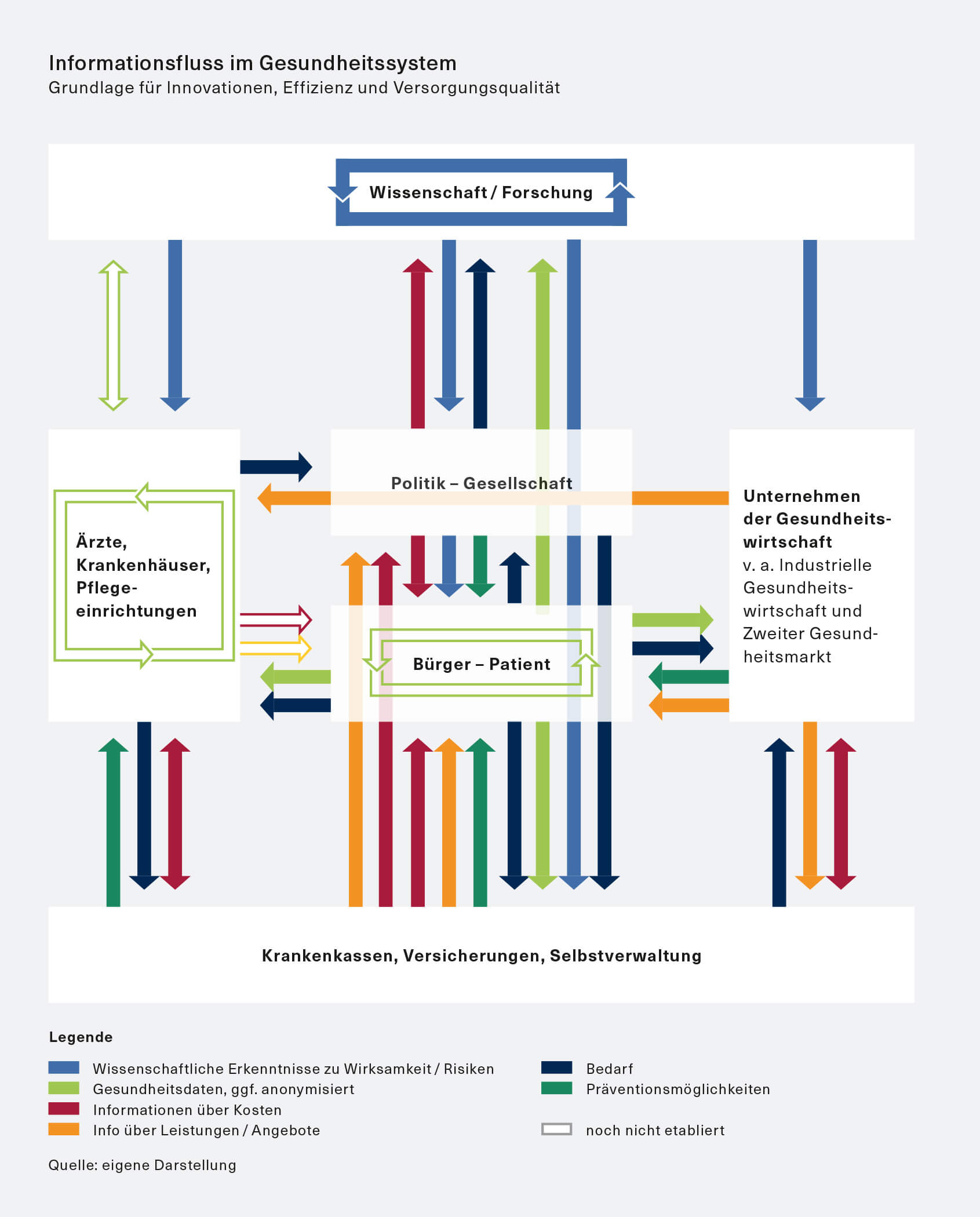
Besserer Informationsfluss im System
Ganz entscheidend wird es sein, den Informations- und Wissensaustausch zwischen allen Akteuren des Gesundheitssystems zu verbessern. Er ist Grundlage sowohl für eine bessere Effizienz bei der Leistungserbringung, beispielsweise auch über die Ermöglichung neuer wettbewerblicher Elemente durch mehr Transparenz, als auch für die Weiterentwicklung des Innovationssystems im Ganzen. Beides dient letztlich auch einer höheren Versorgungsqualität. Zusätzlich kann so auch mehr Eigenverantwortung des Patienten ermöglicht werden.